
Nature子刊:北京大学王凯团队等通过瞬时激活NKX3.1,高效驱动iPS细胞分化为壁祖细胞
Nature子刊:北京大学王凯团队等通过瞬时激活NKX3.1,高效驱动iPS细胞分化为壁祖细胞
血管壁细胞(Mural cells)是周细胞(Pericytes)和血管平滑肌细胞(Vascular smooth muscle cells)的统称,是血管的重要组成部分,对维持血管的稳定性和功能至关重要。
当壁细胞失调时,会导致血管结构和功能异常,影响血管生成和稳定。因此,研究功能性壁细胞对于理解健康和疾病中的血管功能以及开发针对血管周细胞的新型治疗方法是必不可少的。
人诱导多能干细胞(hiPSCs)的出现为获得患者特异性壁细胞提供了一种可能的非侵入性的方法。通过化学诱导获得壁细胞分化方法主要基于血管发育过程,先将干细胞分化为间介中胚层祖细胞(intermediate mesodermal progenitor cells,MePCs),再利用TGFβ和PDGF信号驱动分化为平滑肌细胞。相较而言,利用转录因子诱导分化壁细胞的研究相对较少。若能找到诱导壁细胞分化的关键转录因子,则将为精确控制分化时间、同时分化多种细胞类型等探索提供可能。
近日,北京大学基础医学院王凯课题组与哈佛大学医学院/波士顿儿童医院Kaifu Chen和Juan M. Melero-Martin研究团队合作,在 Nature Communications 期刊发表了题为 Robust differentiation of human pluripotent stem cells into mural progenitor cells via transient activation of NKX3.1 的研究论文【1】。
该研究通过在中胚层祖细胞瞬时激活NKX3.1,能高效驱动其分化为壁祖细胞(mural progenitor cells,MPCs)。这些由iPSC来源的壁祖细胞(iMPCs)在与内皮细胞(ECs)共培养后能够进一步成熟为不同的功能性壁细胞亚群,包括平滑肌细胞和周细胞。这些iMPCs具有关键的壁细胞功能,如收缩性、细胞外间质沉积,以及支持内皮细胞介导的血管网络形成的能力,在血管修复和再生医学应用方面拥有巨大潜力。

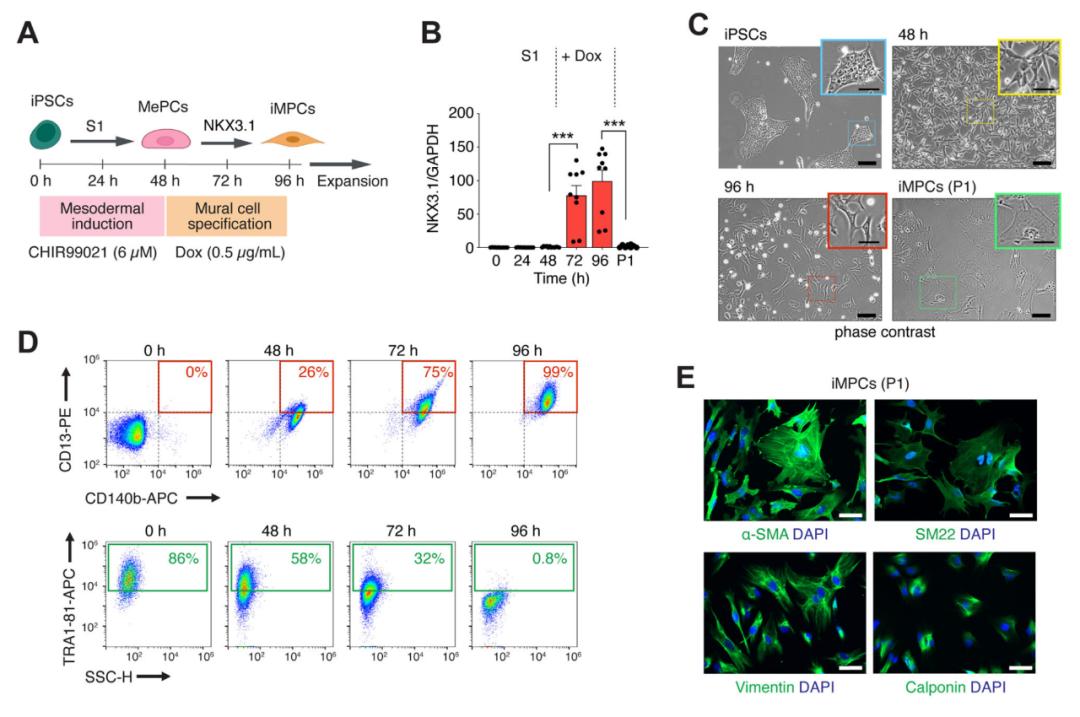
研究团队首先构建了利用Dox激活NKX3.1表达的iPSC细胞系。接下来建立了两步走的分化方案:第一步,使用糖原合成酶激酶3抑制剂CHIR99021激活Wnt信号通路,将iPSCs分化为MePCs;第二步,在没有任何生长因子的情况下,使用Dox激活 NKX3.1,持续表达48小时。然后将获得的iMPCs在含血清的平滑肌生长培养基(SMGM)中再培养一段时间。
在NKX3.1表达激活48小时后,流式细胞术显示约99%的细胞表现为CD140b+和CD13+ 。分化结束后,能观察到细胞形态的显著变化,免疫荧光证实iMPCs中表达壁细胞特异性细胞骨架蛋白(α-SMA、SM22、calponin、vimentin)。由于NKX3.1仅短暂表达,使用化学修饰的mRNA(modRNA)转染以瞬时表达NKX3.1也能有效产生iMPCs。
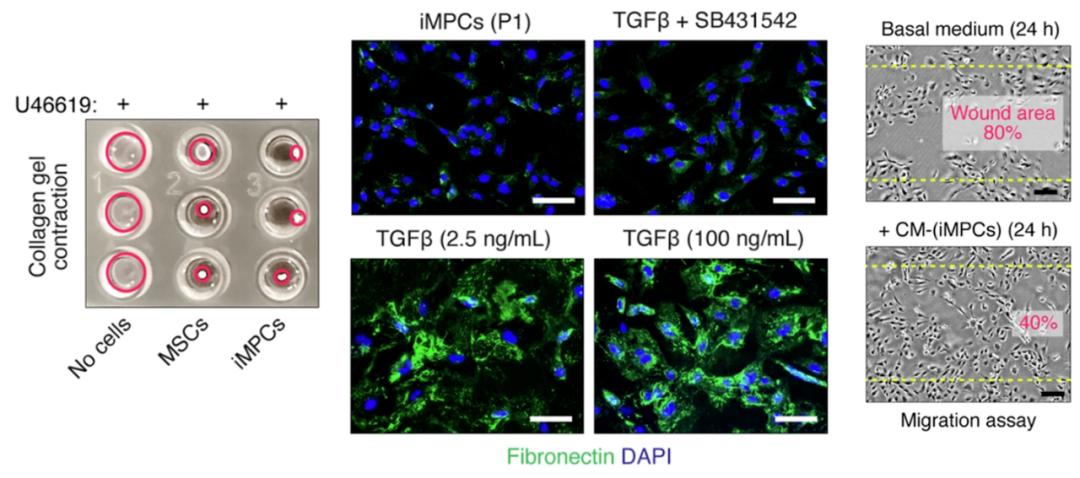
接下来,研究团队从多个方面评估了iMPCs的功能性。与人壁细胞相似,iMPCs表现出在血管收缩剂刺激下的收缩性、TGF-β介导的细胞外纤维连接蛋白沉积、多种促血管生成因子的分泌(包括VEGF-A、PLGF、HB-EGF、HGF 等)、调节内皮细胞活性。
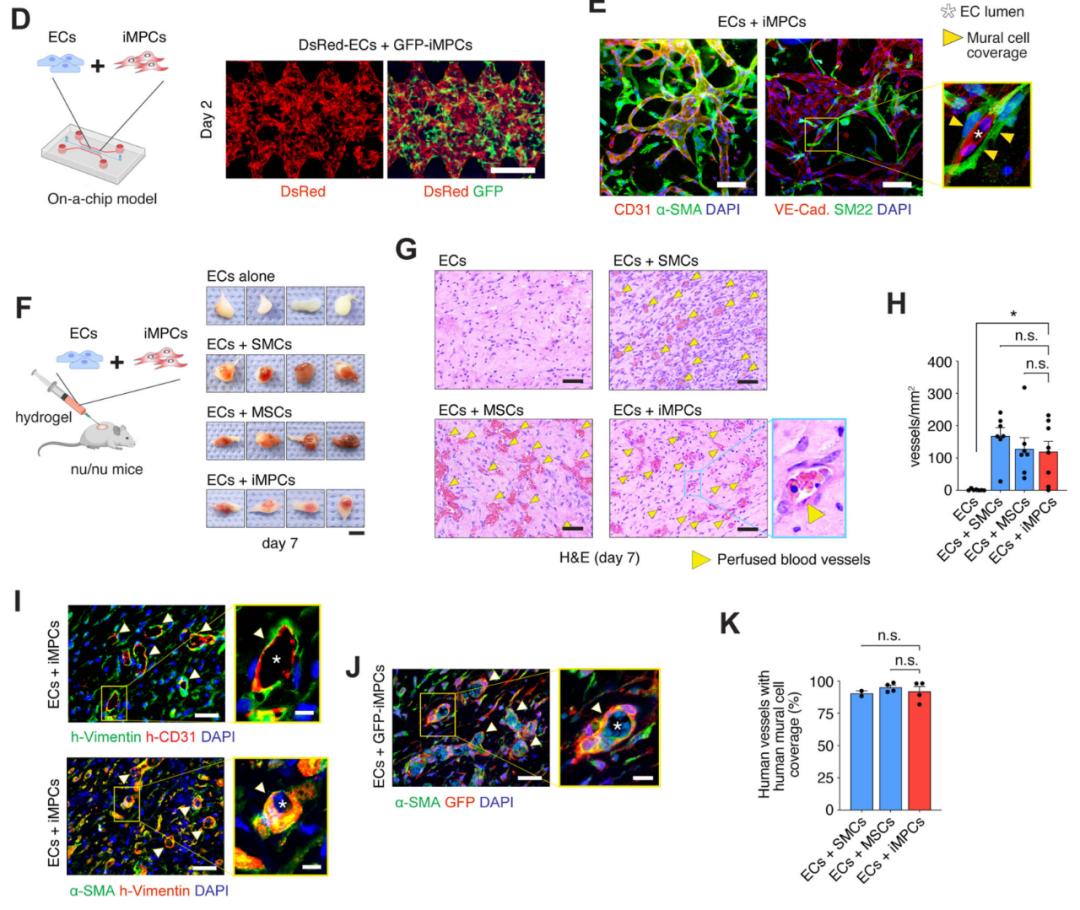
为了研究iMPCs是否可以调节内皮细胞(ECs)活性,研究团队将iMPCs与内皮细胞共培养于微流控芯片中,证实了iMPCs与ECs共培养可组装复杂血管网络,iMPCs能实现其作为壁细胞的功能。将iMPCs与ECs共移植入免疫缺陷小鼠皮下,能形成可灌注的血管,新形成的血管与宿主血管吻合,且功能正常;而单独移植ECs并不能形成可灌注的血管。移植的iMPCs包绕在移植的ECs旁,表明iMPCs参与构成血管壁。
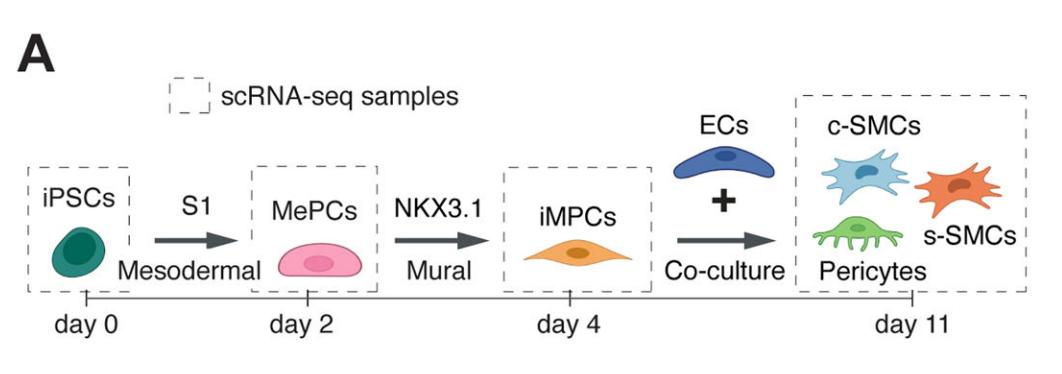
iMPCs不仅能调节内皮细胞活性,也能响应内皮细胞的调节。分析转录组学显示,与内皮细胞共培养的iMPCs更加成熟,这也表现出iMPCs的前体细胞特征。与ECs共培养成熟的iMPCs表现为三种细胞类群,包括周细胞、收缩性平滑肌细胞、合成型平滑肌细胞。此外,iMPCs衍生的周细胞和平滑肌细胞与原代细胞相比具有较好的一致性。
这项研究证明,在中胚层细胞瞬时激活NKX3.1,是一种快捷、高效的分化获得iMPCs的方法。文中展示了两种瞬时激活NKX3.1的方法,其中通过modRNA激活NKX3.1的表达是一种无需基因编辑、非病毒、非整合的方法,在临床应用领域具有更大潜力。通过这种方法可获得患者特异性的壁细胞,可用于疾病建模和再生医学,具有广阔的转化和应用前景。
值得一提的是,2020年,彼时师从Juan M. Melero-Martin的王凯博士在 Science Advances 期刊发表了题为:Robust differentiation of human pluripotent stem cells into endothelial cells via temporal modulation of ETV2 with modified mRNA 的研究论文,利用modRNA在中胚层祖细胞瞬时激活ETV2,能高效驱动其分化为内皮细胞。这些内皮细胞在表型和功能上都表现出内皮细胞的特性,且移植入体内后能形成具有灌注能力的血管网络。

若将能瞬时激活ETV2表达的中胚层祖细胞与能瞬时激活NKX3.1表达的中胚层祖细胞以一定方式共培养,或许能高效获得具有内皮细胞、周细胞与血管平滑肌细胞的血管类器官,为临床转化与应用提供了很有潜力的研究平台。
论文链接:
1. https://www.nature.com/articles/s41467-024-52678-8
2. https://www.science.org/doi/10.1126/sciadv.aba7606


