
Science| 孙金鹏/姜长涛/孔炜/于晓鉴定神经酰胺的膜受体FPR2并揭示其调控脂肪产热的作用机制
神经酰胺作为鞘磷脂代谢通路的核心分子,其研究历史可追溯至19世纪末。1884年,德国化学家Johann L. W. Thudichum首次从脑组织中分离出鞘脂类物质,并命名为"sphingolipids",取自希腊神话中的斯芬克斯(Sphinx),寓意这类分子的神秘性。神经酰胺结构多样性丰富,在哺乳动物体内已鉴定出约300种类型。其分子结构由两条链构成:一条为脂肪酸链,另一条为鞘氨醇链。脂肪酸链的特异性取决于其碳链长度和不饱和双键的位置;鞘氨醇链则包括二氢鞘氨醇(DS)、6-羟基鞘氨醇(H)等多种类型。此外,神经酰胺还可通过鞘脂基团的修饰(如磷酸化、葡萄糖基化、半乳糖基化等)进一步增加其结构多样性,从而赋予其不同的生物学功能。临床研究表明,循环神经酰胺水平升高与多种代谢性疾病密切相关,包括2型糖尿病、肥胖症、非酒精性脂肪肝及动脉粥样硬化等。近年来发现,神经酰胺具有快速调控现象(如数分钟内影响葡萄糖转运),提示可能存在尚未明确的膜受体
有趣的是,神经酰胺分子的两部分:鞘氨醇骨架和可变链长的脂肪酸链,均具有独立激活G蛋白偶联受体(GPCR)的能力,从而介导不同的生物学功能。在鞘氨醇信号通路中,鞘氨醇-1-磷酸(S1P)作用于S1P受体家族(S1PR1-5),在淋巴细胞迁移、血管稳态维持等生理过程中发挥重要调控作用,基于这一机制研发的靶向药物已在多发性硬化症等自身免疫性疾病的临床治疗中取得显著成效。孙金鹏教授团队和艾丁教授、朱毅教授团队合作发现了17,18-EEQ通过S1PR1偏向性激活Gq信号,调控动脉粥样硬化的进展(Nat Metab. 2024 Aug;6(8):1566-1583)。神经酰胺的另一部分脂肪酸的结构特征(包括碳链长度、双键构型及不饱和键位置等)也被证实是GPCR信号识别的重要决定因素。孙金鹏教授和于晓教授团队联合发现胰岛内源性脂质-油酸(OA)和亚油酸(LA)两种长链脂肪酸(LCFA)激活脂肪酸受体GPR120对胰岛稳态具有调控作用,揭示了鱼油受体GPR120识别脂肪酸中单双键并引起不同信号转导的机制(Science. 2023 Apr 7;380(6640):eadd6220)。进一步研究表明,神经酰胺可抑制细胞内的cAMP积累(这一现象通常与Gi/o蛋白偶联受体的激活相关),一个重要科学问题随之浮现:是否存在特定的GPCR亚型能够直接识别完整神经酰胺分子,并通过调控第二信使动态平衡来介导关键的细胞应答?
2025年3月14日,由北京大学基础医学院/山东大学孙金鹏教授团队牵头,联合北京大学医学部基础医学院姜长涛教授和孔炜教授团队,山东大学于晓教授团队,在Science在线加速发表了研究论文“Metabolic signaling of ceramides through the FPR2 receptor inhibits adipocyte thermogenesis”。该研究鉴定出脂肪细胞中的神经酰胺膜受体FPR2,系统阐明了神经酰胺-FPR2信号轴调控脂肪产热的作用机制,揭示了FPR2特异性识别神经酰胺的分子基础。这项突破性工作不仅为深入理解神经酰胺的生物学功能提供了全新视角,更为代谢性疾病的靶向治疗开辟了新的研究方向。
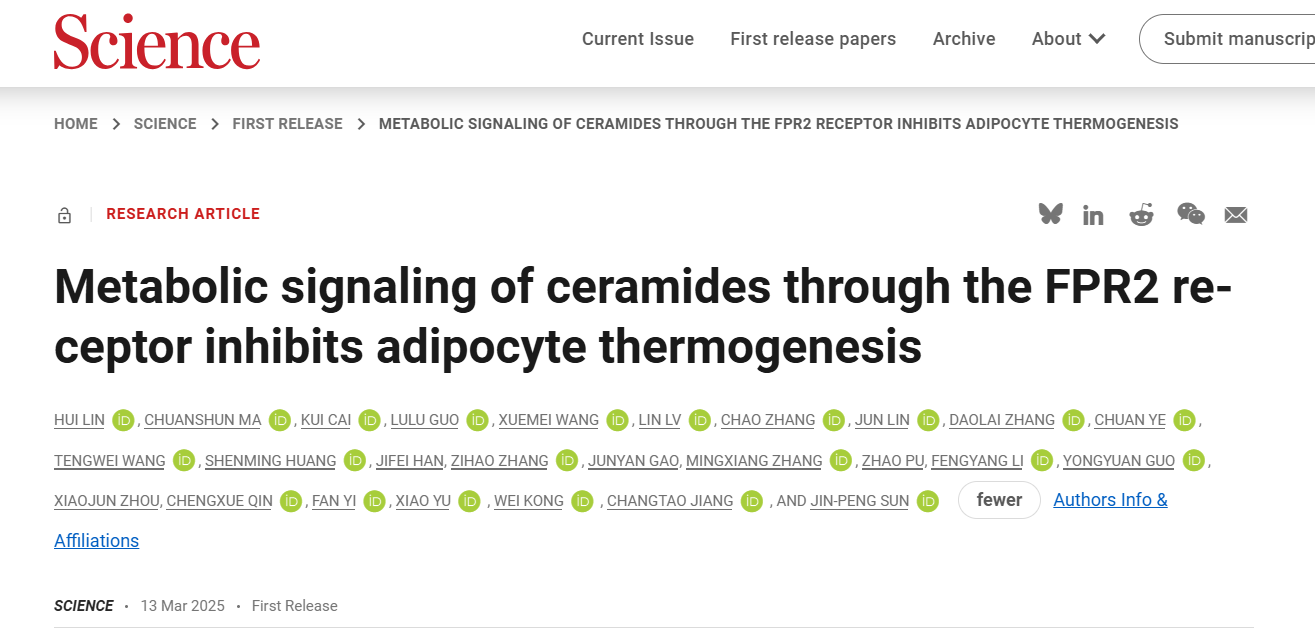
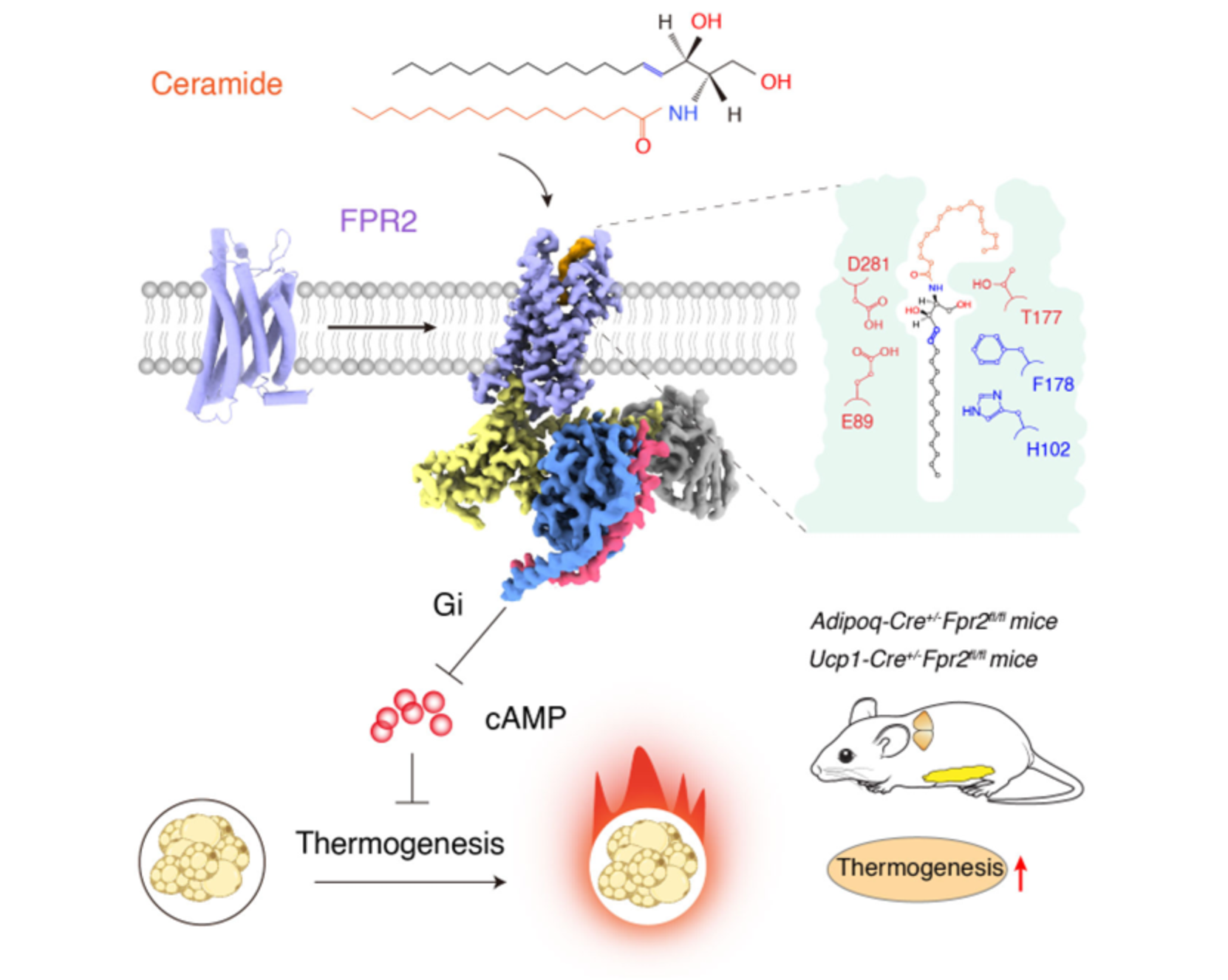
神经酰胺作为重要的代谢分子,引起了广泛研究。其中,C16:0神经酰胺(d18:1/16:0 ceramide)作为重要的亚型,被证实会抑制脂肪细胞的产热功能,并在调节小鼠体内脂肪堆积中发挥重要作用(Nat Commun. 2015 Dec 15;6:10166;Cell Metab . 2019 Nov 5;30(5):937-951.e5)。cAMP是调控脂肪产热的关键分子,研究团队在体外实验中发现,C16:0神经酰胺短时间刺激(15分钟)会降低棕色脂肪组织、米色脂肪组织及其相应细胞内的cAMP含量,提示可能存在一种Gi偶联的GPCR受体介导C16:0神经酰胺对脂肪组织产热的快速调控作用。随后,团队利用GloSensor-cAMP方法筛选棕色脂肪中表达量前60位的GPCR,发现C16:0神经酰胺可通过激活FPR2受体导致cAMP含量下降。通过BRET-G蛋白解离实验进一步验证,发现C16:0神经酰胺通过激活FPR2的Gi1和Gi2信号通路发挥作用,最终确定FPR2是脂肪细胞中Gi偶联的神经酰胺受体 (图一)。
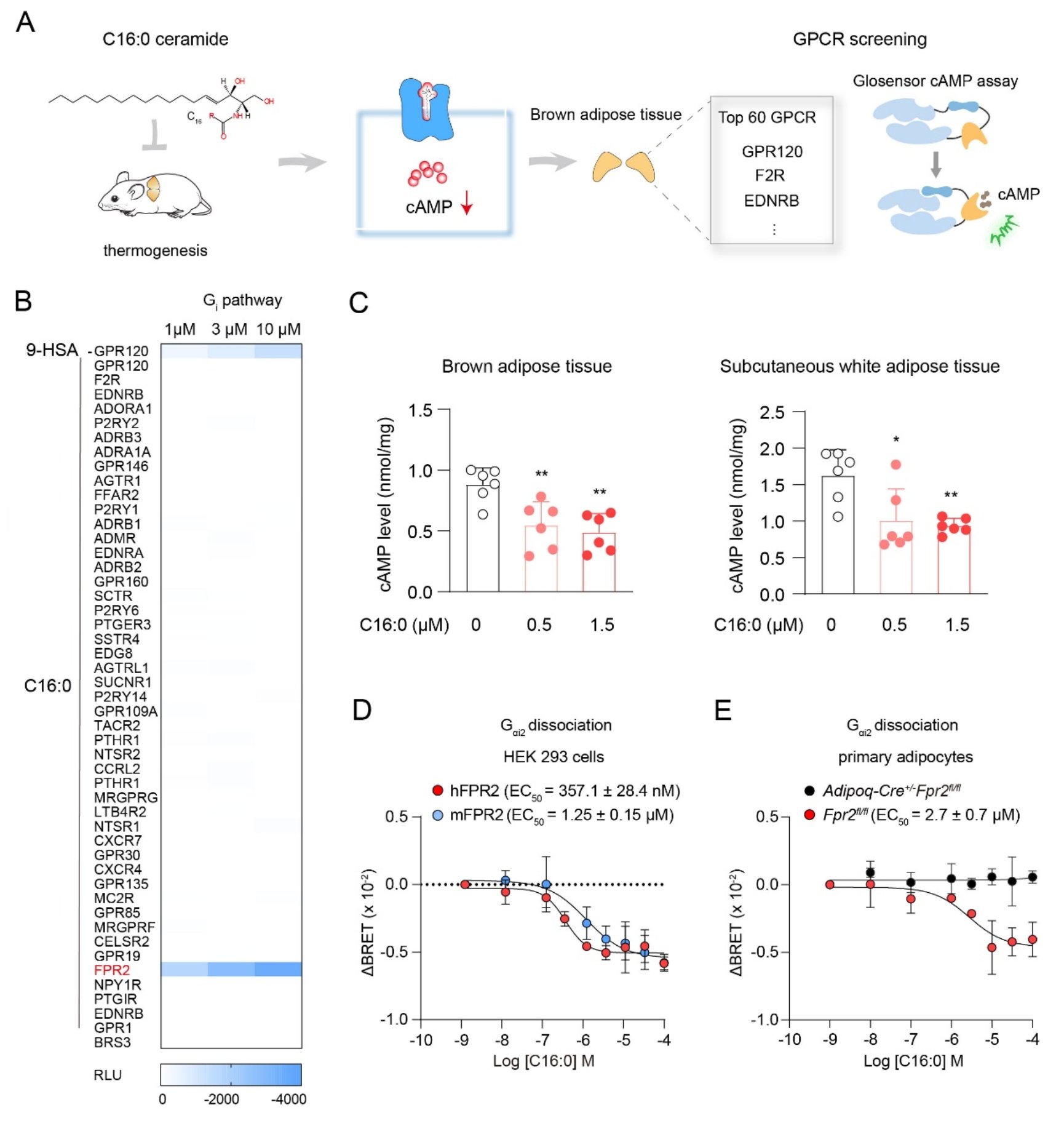
图一 筛选鉴定FPR2是神经酰胺的膜受体
为了验证C16:0神经酰胺与 FPR2 之间是否存在直接相互作用,研究团队采用了放射性同位素配体结合和FlAsH-BRET传感器方法。实验结果表明,C16:0神经酰胺与FPR2之间存在直接相互作用。在放射性同位素配体结合实验中,C16:0神经酰胺在棕色脂肪组织和皮下白色脂肪组织中的结合亲和力(Ki值),分别为600.5 ± 38.9 nM和190.7 ± 25.7 nM。FlAsH - BRET 传感器实验进一步显示,C16:0神经酰胺与FPR2结合可触发受体特异性的胞外构象变化,表现为FPR2的N端向ECL1和ECL2区域靠近 (图二)。
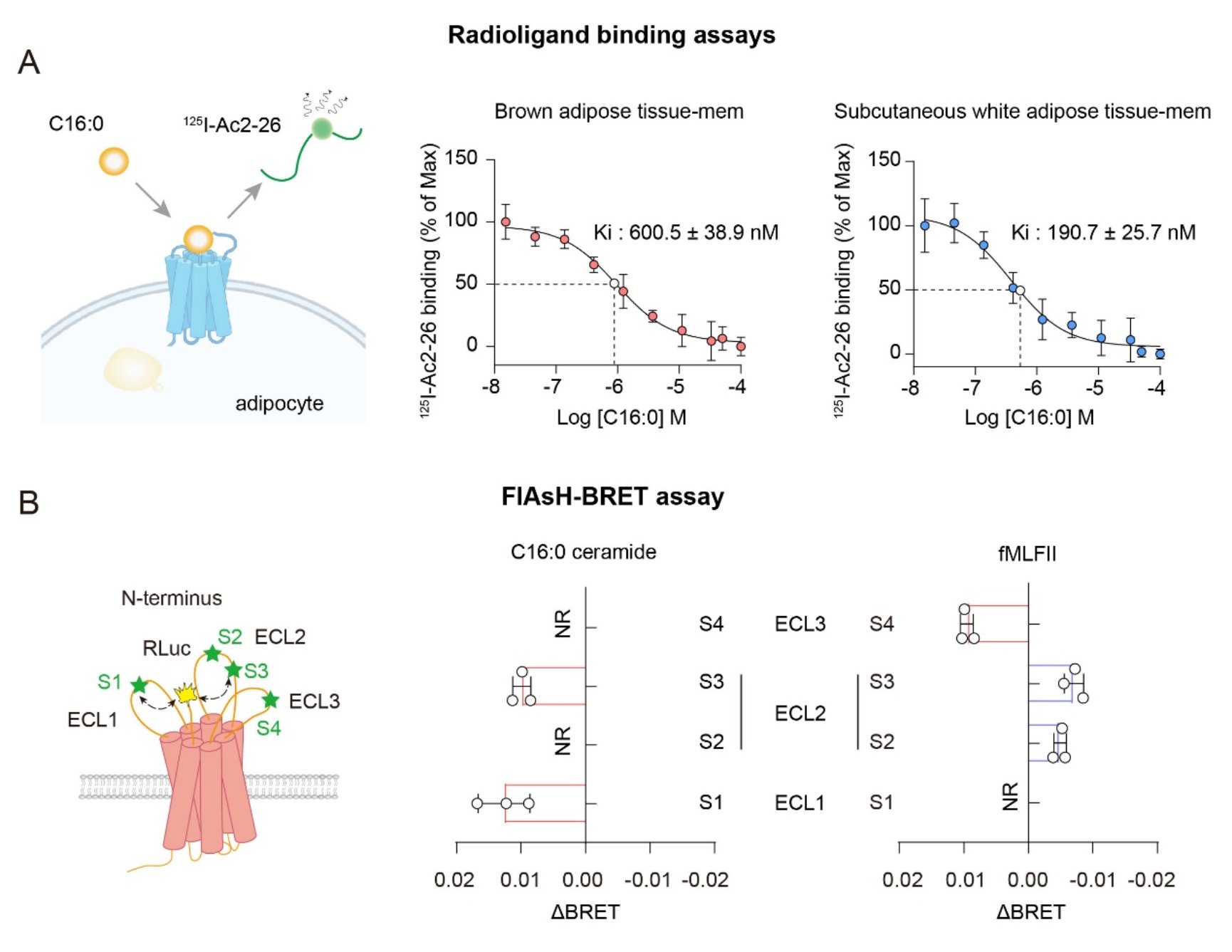
图二 脂肪细胞中C16:0神经酰胺与FPR2的直接相互作用
为了明确FPR2是否介导C16:0神经酰胺对脂肪产热的抑制作用,研究团队构建了冷刺激产热模型。发现在Ucp1-Cre+/−Fpr2fl/fl和Adipoq-Cre+/−Fpr2fl/fl两种敲除小鼠中,或通过使用FPR2的拮抗剂WRTW4干预后,在不影响小鼠饮食和运动的情况下,均显著减轻神经酰胺对脂肪产热的抑制作用,小鼠表现为能量代谢和氧消耗量的显著增加、体温升高,且脂肪组织中产热基因表达及UCP1蛋白水平上调。上述结果表明,在生理冷刺激条件下,C16:0神经酰胺通过激活脂肪细胞的FPR2受体抑制产热。
脂肪产热是抵抗肥胖的关键机制。为了探究神经酰胺在肥胖中的作用,研究团队分别构建了高脂饮食诱导的适应性产热模型和肥胖模型。在适应性产热模型中,Adipoq-Cre+/−Fpr2fl/fl小鼠的脂肪产热能力增强,同时其糖耐量受损和胰岛素抵抗显著改善。在肥胖模型中,与对照组相比,Adipoq-Cre+/−Fpr2fl/fl小鼠的体重增长显著减缓,且肝脏组织、皮下白色脂肪组织、内脏白色脂肪组织和棕色脂肪组织的重量及甘油三酯水平显著下降。上述结果表明,靶向FPR2受体可能通过调控脂肪产热影响肥胖及相关代谢紊乱的进程(图三)。
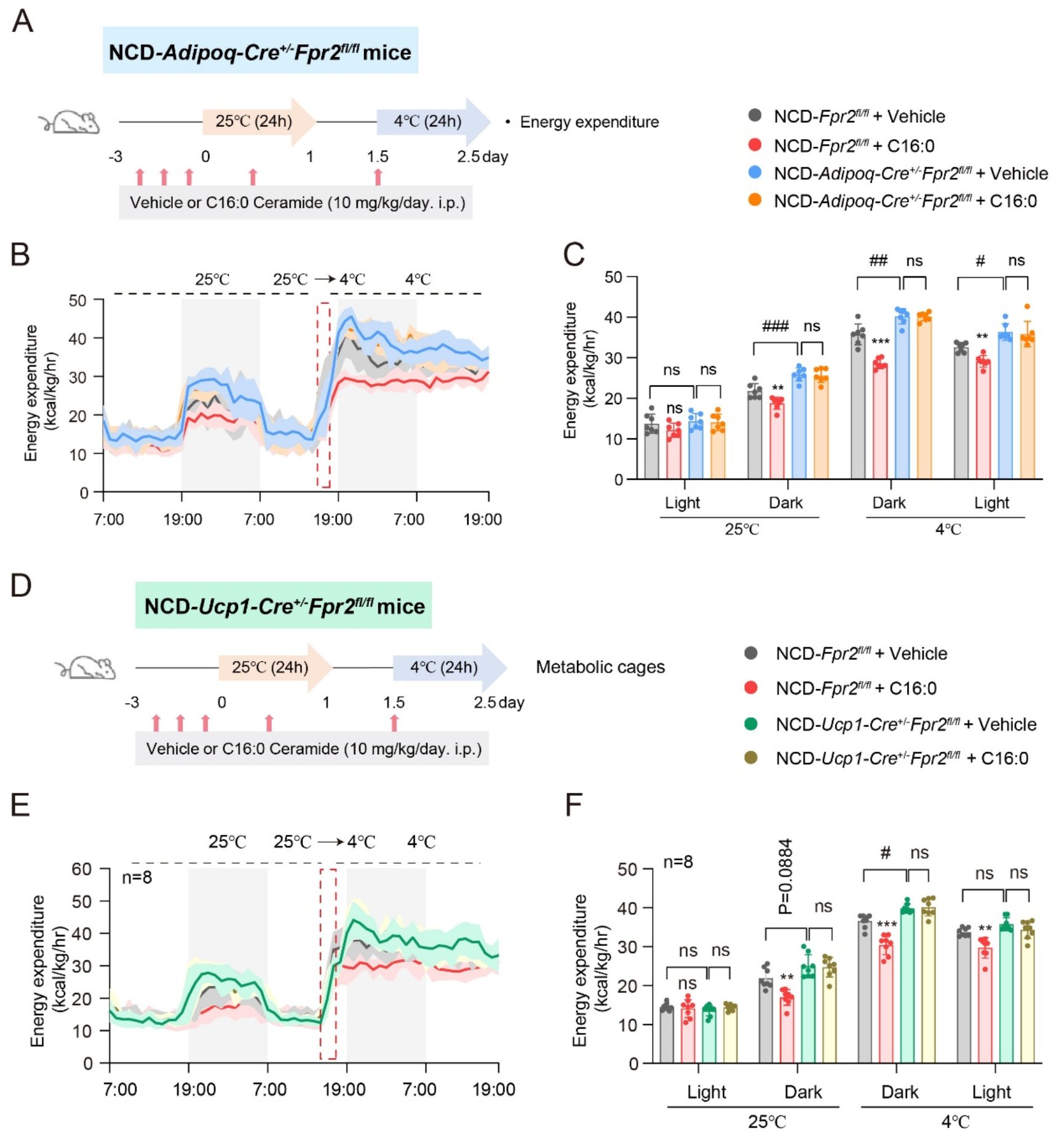
图三 C16:0神经酰胺通过FPR2抑制冷暴露诱导的产热
最后,研究人员解析了神经酰胺-FPR2-Gi复合物的三维结构。发现神经酰胺的鞘链深埋于FPR2正构结合口袋底部,而脂肪酸链则在口袋上方呈现特征性折叠构象(“p”或“s”形)。这种独特的结合模式阐释了FPR2对神经酰胺的选择性识别机制——过长的脂肪酸链和含双键脂肪酸链的神经酰胺会因口袋可容纳空间不足导致结合能显著降低。基于此发现,研究人员通过系统性的定点突变策略,成功将FPR1/FPR3(同家族非神经酰胺敏感受体)改造为神经酰胺响应型受体。这不仅验证了关键功能基序的分子逻辑,更为GPCR家族的功能重编程提供了范式参考 (图四)。
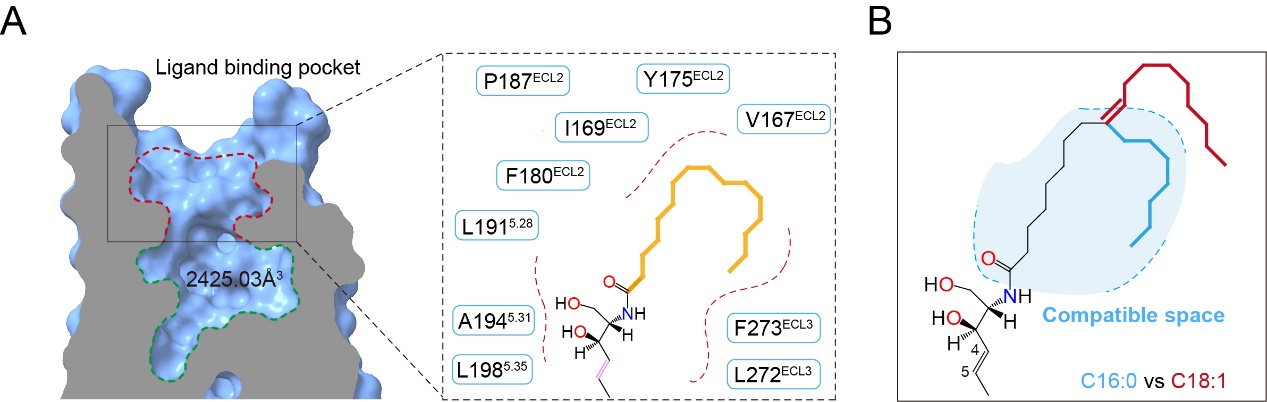
图四FPR2识别不同长链神经酰胺的分子机制
综上所述,这项研究鉴定了FPR2为脂肪细胞中的神经酰胺膜受体,阐明其通过Gi-cAMP信号级联抑制脂肪组织产热的功能机制,并解析了FPR2选择性识别不同链长神经酰胺的结构密码。值得关注的是,在同期《Nature》发表的姊妹研究中,孔炜教授团队联合孙金鹏教授团队、姜长涛教授团队以及郑金刚教授团队进一步发现心血管系统存在CYSLTR2和P2RY6神经酰胺新型受体,揭示神经酰胺信号网络具有显著的组织异质性与功能复杂性。这一系列研究构建了神经酰胺信号转导的分子拓扑图谱,更颠覆了脂质分子仅通过扩散作用调控代谢的传统认知。基于受体结构开发的变构调节剂与脂质纳米靶向载药系统,将为肥胖、2型糖尿病等代谢综合征提供精准干预策略。
山东大学口腔医学院博士后林慧,山东大学基础医学院博士生马传顺,北京大学基础医学院博士生蔡葵,山东大学高等医学研究院研究员郭璐璐,北京大学基础医学院博士后王雪梅,山东大学基础医学院博士生吕琳、张超和北京大学基础医学院博士后林骏为本文的共同第一作者;北京大学基础医学院/山东大学孙金鹏教授,北京大学基础医学院姜长涛教授、孔炜教授,山东大学基础医学院于晓教授为本文的通讯作者。此外,山东大学基础医学院易凡教授、药学院秦承雪教授也为该工作提供了重要帮助。
原文链接:https://www.science.org/doi/10.1126/science.ado4188

孙金鹏教授团队长期致力于膜受体G蛋白偶联受体的相关研究,聚焦于GPCR的配体发现、药物靶点确证、功能研究和小分子确证,取得了系列原创性研究成果,在破解“卡脖子”技术难题、推动科研高质量发展方面取得一系列重要突破。以通讯作者在Nature(9篇),Science(2篇),Cell (4篇)等国际期刊发表多篇文章。揭示了粘附类受体(aGPCRs)是识别类固醇激素的GPCR亚家族(Nature 2021, 589: 620-626;Nat Chem Biol 2022, 18(11):1196-1203;PNAS 2022, 119(15):e2117004119);揭示了痒觉受体的内源性配体和独特的激活模式(Nature. 2021;600(7887):164-169);阐释了黏附类受体对力的感知机制并发展了多肽激动剂和拮抗剂(Nature. 2022a 604(7907):771-778; Nature. 2022b 604(7907):763-770); 解析了嗅觉受体对气味的感知机制(Nature. 2023 Jun;618(7963):193-200)。研究成果入选2023年中国十大科技进展。

姜长涛教授从事肠道菌群及其菌源酶与代谢性疾病的研究,形成“肠道菌源酶跨物种调控宿主稳态”新理论,提出“肠道菌源宿主同工酶”新概念,揭示菌源宿主同工酶在调节宿主代谢稳态、介导临床药物响应性方面的新功能;发现菌群与宿主互作的关键信使—胆汁酸的多种全新菌源修饰类型及生物合成通路,是代谢性疾病防治的新策略;揭示神经酰胺是器官间互作的关键介质,阐明多种菌源酶调节神经酰胺的新机制。获2024、2023年度中国生命科学十大进展、2023年度中国高等学校十大科技进展等奖励,近五年在Science、Nature、Cell等期刊发表论文30余篇。

