
Advanced Science:周菁团队与合作者揭示静脉植物脂肪酸代谢重编程的力学调控机制
2024年11月26日,北京大学基础医学院生理学与病理生理学系周菁课题组、深圳湾实验室彭琴课题组、北京大学人民医张韬等合作在Advanced Science杂志在线发表了题为Mechanical Activation of cPLA2 Impedes Fatty Acid β-Oxidation in Vein Grafts的研究论文。该研究揭示了细胞核感知高机械牵张,通过抑制血管平滑肌细胞脂肪酸氧化,促进细胞增殖与迁移的新机制,为临床上动-静脉移植后血管再狭窄干预策略研究提供了新的见解。

冠状动脉旁路移植术是阻塞性冠状动脉疾病患者的金标准治疗方法[1]。但50%的静脉移植物在术后10年出现血管再狭窄和梗阻等病理性重塑,严重影响预后[2]。高强度机械牵张诱导血管平滑肌细胞(vascular smooth muscle cell, VSMC)过度增殖和迁移已被证明是导致血管狭窄的重要原因之一[3, 4]。周菁课题组的前期研究发现,机械牵张促进VSMC代谢重编程,诱导从氧化磷酸化到糖酵解的转变[5]。尽管有研究证明其他细胞代谢途径,如脂肪酸β氧化,参与了VSMC的功能调节[6, 7],但在血管病理性重塑过程中的作用仍不清楚。
肉碱棕榈酰转移酶1-B(carnitine palmitoyltransferase1-B, CPT1B)位于线粒体外膜,将长链脂肪酰基辅酶从细胞质转运到线粒体,是脂肪酸β-氧化的关键酶。有研究表明,血管平滑肌细胞脂肪酸β-氧化抑制,可诱导细胞增殖与血管损伤后内膜增生[8, 9],然而,CPT1B在机械牵张促进VSMC增殖中的作用仍不清楚。在此项研究中,研究者通过小鼠动-静脉移植模型以及体外机械牵张加载模型,结合转录组学、代谢组学、同位素标记和免疫荧光等技术,发现静脉移植和机械牵张导致血管平滑肌细胞CPT1B下调、脂肪酸氧化水平下调以及细胞增殖和迁移能力增强。
为探索机械牵张如何抑制脂肪酸氧化,研究者通过荧光显微成像与荧光共振能量转移等实验,证明机械牵张导致血管平滑肌细胞核膜张力增加和细胞质磷脂酶A2(cytosolic phospholipase A2,cPLA2)激活。破坏细胞核的力学信号转导途径结果显示,核膜张力增加促进cPLA2激活。通过ChIP、荧光素酶报告基因实验和蛋白免疫印迹等技术,此研究进一步进行机制研究,结果显示cPLA2激活后,通过促进转录因子YY1的泛素-蛋白酶依赖性降介导CPT1B下调,脂肪酸β-氧化不足会增加核膜张力,从而协调cPLA2的激活。
体外细胞增殖与迁移实验及体内研究结果也证实,腺病毒过表达CPT1B或抑制核膜拉伸对cPLA2的激活均能抑制由机械牵张诱导的血管平滑肌细胞增殖和迁移,并减轻移植静脉新生内膜增生。
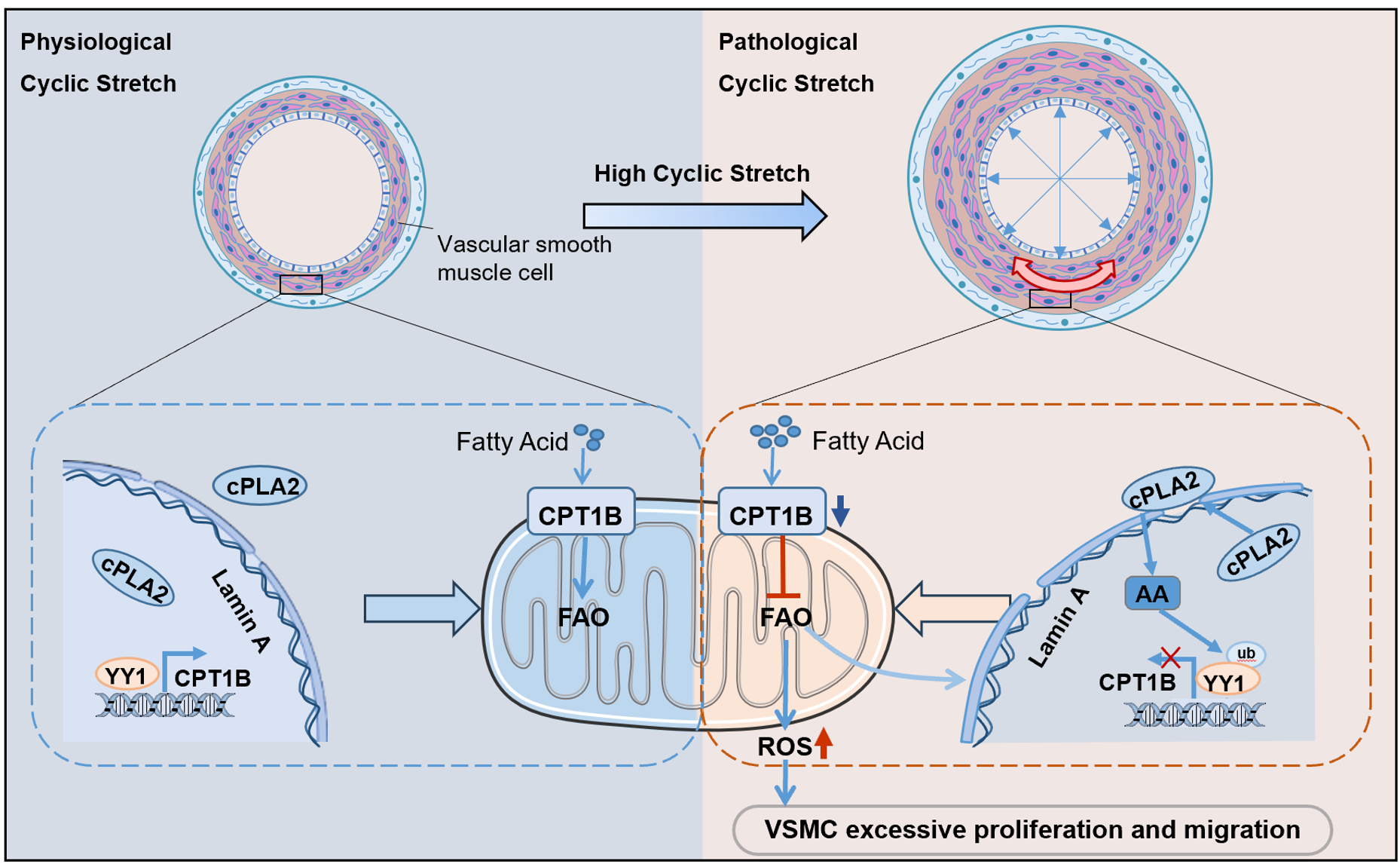
cPLA2感知机械牵张通过ArAc-YY1-CPT1B通路调控FAO水平
北京大学基础医学院生理学与病理生理学系博士生樊林玮为该论文的第一作者,北京大学生理学与病理生理学系周菁教授、深圳湾实验室彭琴研究员、北京大学人民医院血管外科张韬教授为共同通讯作者。该工作还得到了北京大学心血管研究所郭宇轩研究员和冼勋德研究员的支持与帮助。该研究得到了国家自然科学基金委和科技部的项目资助。
原文链接:http://doi.org/10.1002/advs.202411559
参考文献
[1]THUIJS D, KAPPETEIN A P, SERRUYS P W, et al. Percutaneous coronary intervention versus coronary artery bypass grafting in patients with three-vessel or left main coronary artery disease: 10-year follow-up of the multicentre randomised controlled SYNTAX trial [J]. Lancet, 2019, 394(10206): 1325-34.
[2]CAMPEAU L, ENJALBERT M, LESPéRANCE J, et al. Atherosclerosis and late closure of aortocoronary saphenous vein grafts: sequential angiographic studies at 2 weeks, 1 year, 5 to 7 years, and 10 to 12 years after surgery [J]. Circulation, 1983, 68(3 Pt 2): Ii1-7.
[3]OWENS C D. Adaptive changes in autogenous vein grafts for arterial reconstruction: clinical implications [J]. J Vasc Surg, 2010, 51(3): 736-46.
[4]WADEY K, LOPES J, BENDECK M, et al. Role of smooth muscle cells in coronary artery bypass grafting failure [J]. Cardiovasc Res, 2018, 114(4): 601-10.
[5]TANG Y, JIA Y, FAN L, et al. MFN2 Prevents Neointimal Hyperplasia in Vein Grafts via Destabilizing PFK1 [J]. Circ Res, 2022, 130(11): e26-e43.
[6]LEGCHENKO E, CHOUVARINE P, BORCHERT P, et al. PPARγ agonist pioglitazone reverses pulmonary hypertension and prevents right heart failure via fatty acid oxidation [J]. Sci Transl Med, 2018, 10(438).
[7]SUTENDRA G, BONNET S, ROCHEFORT G, et al. Fatty acid oxidation and malonyl-CoA decarboxylase in the vascular remodeling of pulmonary hypertension [J]. Sci Transl Med, 2010, 2(44): 44ra58.
[8]LI X, WU F, GüNTHER S, et al. Inhibition of fatty acid oxidation enables heart regeneration in adult mice [J]. Nature, 2023, 622(7983): 619-26.
[9]SHEN H, EGUCHI K, KONO N, et al. Saturated fatty acid palmitate aggravates neointima formation by promoting smooth muscle phenotypic modulation [J]. Arterioscler Thromb Vasc Biol, 2013, 33(11): 2596-607.

