
转:张炜真课题组揭示小肠外泌体调节肝脏脂代谢
Original Article | 张炜真课题组揭示小肠外泌体调节肝脏脂代谢
非酒精性脂肪肝(NAFLD)由肝脏脂质蓄积过多引起,其发病率高,可进展为肝硬化、肝癌。为了提升防治效果,需要深入研究NAFLD的调控机制。
肠与肝脏联系密切,众多调节肝脏代谢的物质由肠道产生或吸收。来自肠组织的外泌体能通过内含物影响受体细胞生命活动,因而可能参与调控肝脏脂质稳态,但此前未曾得到证实。
2023年12月,北京大学基础医学院张炜真教授课题组在《Life Metabolism》发表“Regulation of hepatic lipid metabolism by intestine epithelium-derived exosomes ”一文,揭示了肠上皮外泌体对NAFLD的影响。该研究首次提出肠道细胞产生的外泌体是肠调节肝脏脂质代谢的新型媒介,并以microRNA为切入点阐释了小肠上皮外泌体影响肝脏脂代谢的部分机制。
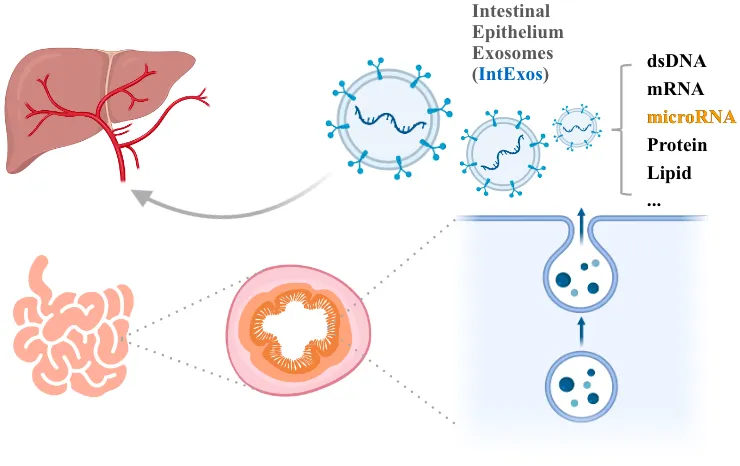
图 1 | 科学假说:小肠上皮外泌体通过携带的microRNA等物质调节肝脏代谢活动
为了检验 “肠来源外泌体调控肝脏脂质代谢” 的科学假说,作者首先使用超速离心法从小鼠小肠上皮细胞分离获得细胞外囊泡,并通过纳米颗粒跟踪分析、蛋白质免疫印迹和透射电镜技术证实其具有外泌体特征。随后在荧光示踪实验中分别观察到小鼠肝脏富集外泌体,肝细胞能够摄取小肠上皮来源外泌体及其携带的microRNA。接下来以肠上皮特异性敲除富含亮氨酸重复序列的G蛋白偶联受体4(Villin-Cre; Lgr4flox/flox,VL)小鼠为研究模型,以基因型为Lgr4flox/flox的同窝小鼠作为对照。之所以选择VL小鼠,是因为其对高脂饮食(High-fat diet,HFD)导致的脂肪肝具有抗性的表型是由肠上皮细胞的基因编辑引起的。为了探究肠上皮外泌体是否是使 VL脂质代谢改善的因素之一,作者用VL或对照小鼠的小肠上皮外泌体孵育肝原代细胞,或尾静脉注射给HFD小鼠,结果均显示VL处理组的肝细胞脂质沉积有所减轻。
因为microRNA具有调控基因表达的功能,并且在外泌体中含量丰富,所以作者探究了肠来源外泌体中 microRNA影响肝脏脂代谢的机制。对Lgr4flox/flox以及VL小肠上皮外泌体进行microRNA测序,获得在两组中含量有显著差异的序列,其中miR-21a-5p在VL组水平升高,miR-145a-5p 则水平降低。作者分别在肝原代细胞和HFD喂养的小鼠肝脏中过表达或敲低上述 microRNA,实验结果均证实miR-21a-5p减轻 NAFLD,而miR-145a-5p加剧肝脏脂肪变性。
接下来作者通过靶基因预测数据库筛选出介导 microRNA调节脂代谢的潜在靶分子,并使用双荧光素酶报告基因实验进行验证。随后进一步用细胞实验表明,miR-21a-5p在肝巨噬细胞内下调靶基因C-C基序趋化因子配体1(C-C motif chemokine ligand 1,Ccl1), 使细胞向抗炎表型极化,从而间接减轻肝实质细胞脂质沉积;miR-145a-5p 通过抑制靶基因 BTG 抗增殖因子1(BTG anti-proliferation factor 1,Btg1),使其下游分子硬脂酰辅酶A去饱和酶1(Stearoyl-CoA desaturase-1,Scd1)含量增加,同时造成脂质蓄积。
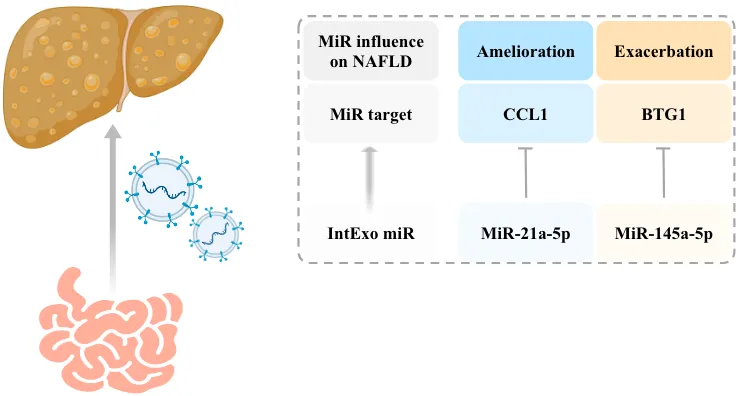
图 2 | 结论:小肠上皮外泌体携带的microRNA通过抑制肝内靶基因表达,调节肝脏脂质代谢
以往,与肠外泌体相关的研究多聚焦于结肠细胞外泌体在炎症性肠病等状态下对邻近组织发挥的作用,或关注与肠道菌群关系密切的肠内容物外泌体对全身糖脂稳态的影响,而无人探讨过肠道自身细胞产生的外泌体如何调节其他代谢器官这一有趣的问题。
本研究填补了这处空白,揭示出小肠上皮外泌体被肝脏摄取,以及这些外泌体携带的miR-21a-5p、miR-145a-5p等对肝脏脂代谢和炎症反应的影响和机制。“外泌体是肠道调控肝脏脂质稳态的一种途径”,这一观点为未来防治肝脏脂质代谢异常相关疾病提供了新思路与潜在的靶点。
北京大学生理系博士毕业生冯天歌为本文第一作者,张炜真教授、尹悦副研究员为共同通讯作者。
本研究由国家自然科学基金、中国科协青年人才托举工程项目资助。


Life Metabolism《生命代谢(英文)》 (CN10-1885/R)是由高等教育出版社和牛津大学出版社联合创办的全新期刊,成功入选中国科技期刊卓越行动计划高起点新刊项目,获国家新闻署创刊批复,DOAJ、Scopus数据库收录。Life Metabolism旨在响应国家重大战略需求,建设世界一流科技期刊, 为实现科技自立自强提供重要支撑; 为科学家提供发声渠道,推动代谢领域科学发展,围绕代谢领域核心生物学问题和代谢性疾病的发病机制发表重要的原创成果。
本期刊创刊前三年出版费用全免,欢迎投稿!
Life Metabolism杂志主页:
https://academic.oup.com/lifemeta
http://www.lifemetab.com
Life Metabolism投稿链接:
https://mc.manuscriptcentral.com/lifemetab


